Un team dell’Università Rockfeller identifica un nutriente che le cellule tumorali bramano
L’arginina è un amminoacido prodotto naturalmente dal nostro corpo e abbondante nel pesce, nella carne e nelle noci che mangiamo. Ma come rivela una recente ricerca su Science Advances , l’arginina è un nutriente essenziale anche per le cellule tumorali. E farli morire di fame potrebbe potenzialmente rendere i tumori più vulnerabili alla risposta immunitaria naturale del corpo.
I ricercatori del Laboratory of Systems Cancer Biology di Sohail Tavazoie presso la Rockefeller University hanno scoperto che in una varietà di tumori umani, questo aminoacido diventa limitato, spingendo queste cellule a cercare una soluzione genetica intelligente: quando i livelli di arginina diminuiscono, manipolano le proteine a loro disposizione per assorbire in modo più efficiente l’arginina e altri amminoacidi . E sorprendentemente, nel tentativo di continuare a crescere, inducono mutazioni che riducono la loro dipendenza da esso.
“È come se avessi un set Lego, e stai cercando di costruire un modello di aeroplano stravagante, e finisci i mattoncini giusti”, dice il primo autore Dennis Hsu, un ex membro del laboratorio di Tavazoie e ora un medico-scienziato presso l’UPMC Hillman Cancer Center di Pittsburgh. “L’unico modo per costruire ancora l’aereo sarebbe se avessi alterato i progetti che non richiedono i mattoni mancanti.”
La connessione arginina-cancro
A livello cellulare, l’arginina svolge un ruolo in una varietà di processi, dallo smaltimento dei rifiuti di azoto alla sintesi proteica. È anche uno dei pochi aminoacidi che ha dimostrato di regolare il modo in cui le cellule immunitarie reagiscono al cancro e ad altri tipi di trigger immunologici, afferma Hsu.
Il suo deficit, ad esempio, è legato ai tessuti infiammati delle persone con morbo di Crohn, colite ulcerosa, malattia infiammatoria intestinale o infezione da H. pylori, i cui tessuti possono avere bassi livelli di arginina. Se le persone con queste condizioni non vengono curate, hanno un rischio maggiore di sviluppare cancro allo stomaco o al colon.
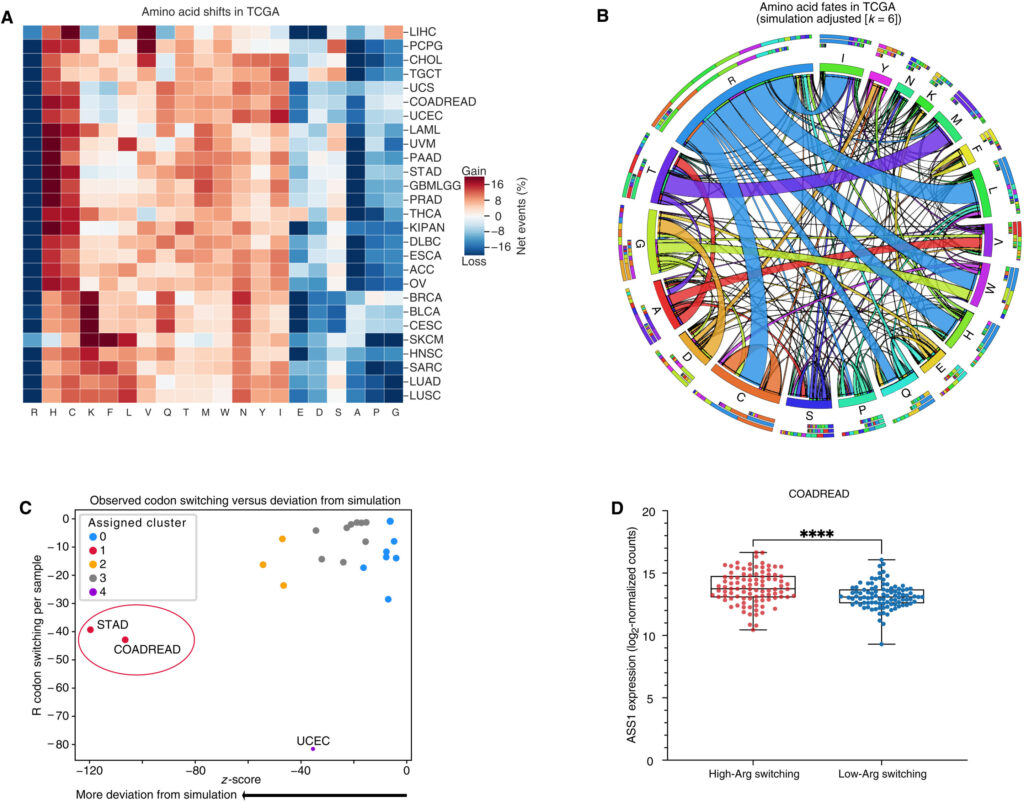
I ricercatori hanno scoperto la connessione arginina-cancro come parte di uno studio più ampio sui codoni, triplette di basi del DNA che contengono ciascuna la ricetta per produrre un singolo amminoacido. Nel setacciare l’Atlante del genoma del cancro, Hsu ha documentato migliaia di casi di mutazioni del codone, ma uno si è distinto tra tutti i tumori: i codoni dell’arginina, che sono stati persi durante le mutazioni molto più di quanto avrebbero dovuto essere. I tumori dello stomaco e del colon-retto hanno mostrato la carenza più drammatica.
“Questa è stata una scoperta molto sorprendente che non ci aspettavamo”, afferma Tavazoie.
I ricercatori non sanno come siano arrivate le prime gocce di arginina. “Pensiamo che alcuni tumori si sviluppino in condizioni di bassa arginina e portino questa storia nel loro DNA”, afferma Hsu.
Malnutrizione cellulare
Hsu e i suoi coautori hanno trascorso mesi in laboratorio a coltivare cellule tumorali e poi a farle morire di fame di arginina. Mentre sottoponevano le cellule a molteplici cicli di malnutrizione cellulare, le cellule tumorali iniziarono a mutare mentre provavano modi diversi per garantire l’accesso a una rinnovata fornitura di elementi essenziali dietetici. Non tutte queste strategie hanno funzionato.
Un metodo di successo è stato quello di aumentare la quantità di proteine trasportatrici di amminoacidi in modo che le cellule potessero assorbire in modo più efficiente l’arginina e altri amminoacidi. Ma anche queste imitazioni funzionali tendevano a essere scarse fonti. Nel frattempo, gli errori si sono aggravati man mano che le cellule si replicavano, determinando modifiche al genoma come geni mutati e proteine deformi.
In un altro esperimento, Hsu ha riscontrato un aumento del numero di mutazioni verso codoni che producono aminoacidi più abbondanti nell’ambiente delle cellule tumorali. Questi improvvisamente sono diventati più appetitosi per le cellule tumorali, che sembravano cercare di accontentarsi di ciò che avevano, come mettere insieme un pasto con alcuni oggetti casuali che si trovano nel tuo frigorifero.
Il collegamento di un nutriente specifico a un cambiamento specifico del DNA attraverso questa sorta di cosiddetta evoluzione diretta “non era stato segnalato prima, a nostra conoscenza”, afferma Tavazoie.
Dalla bandiera rossa al bersaglio
È interessante notare che questa capacità di convincere i codoni a eseguire i loro ordini potrebbe potenzialmente portare alla distruzione delle cellule tumorali. Questo perché nel tentativo di mantenersi in vita mentre sono malnutrite, le cellule accumulano così tante mutazioni che possono iniziare a sembrare molto strane al sistema immunitario.
“Hai un mucchio di proteine casuali, dall’aspetto anormale a causa di tutte le mutazioni, e quelle hanno maggiori probabilità di essere riconosciute dal sistema immunitario come qualcosa che non dovrebbe appartenere a lì”, dice Hsu. Una volta profondamente mutate, le cellule tumorali affamate di arginina che avrebbero potuto volare sotto il radar del sistema immunitario potrebbero ora sventolare una bandiera rossa a brandelli.
I risultati hanno potenziali implicazioni per l’immunoterapia. “Affamando una cellula tumorale, forse puoi promuovere l’acquisizione di nuove mutazioni che possono quindi essere riconosciute dal sistema immunitario”, afferma Hsu. “Non l’abbiamo testato, ma sarebbe una cosa davvero interessante da provare.”
More information: Dennis J. Hsu et al, Arginine limitation drives a directed codon-dependent DNA sequence evolution response in colorectal cancer cells, Science Advances (2023). DOI: 10.1126/sciadv.ade9120

