Nuove informazioni sui linfociti B e sul perché gli esseri umani possono produrre trilioni di anticorpi anti-malattie
Nessuna storia in biologia è più intrigante di quella che coinvolge le cellule B e gli intricati processi che portano alla produzione di anticorpi: è una storia di matematica, una storia di genetica e una saga di come vasti eserciti di minuscoli anticorpi possono controllare una vasta gamma di agenti che causano malattie.
L’argomento delle cellule B e della produzione di anticorpi era un tempo l’argomento arcano di biologi e medici. Ma nella morsa di una pandemia globale che ha causato la morte di oltre 2 milioni di persone, le preoccupazioni per gli anticorpi e la risposta immunitaria sono diventate oggetto di notiziari televisivi quotidiani.
La produzione di anticorpi è al centro delle preoccupazioni per la salute e la sopravvivenza, come le probabilità di recupero da COVID-19 e la capacità dei vaccini di prevenire l’infezione da SARS-CoV-2. Nel corso della vita, gli esseri umani sono in grado di generare 10 trilioni di diverse molecole di anticorpi, un numero così sbalorditivo che solleva la questione di come sia possibile.
Gli anticorpi sono proteine, il che significa che la loro produzione è codificata da geni. Ma la cifra di 10 trilioni presenta quello che sembra un dilemma matematico critico. Come può il genoma umano , composto da 30.000 geni, produrre 10 trilioni di anticorpi diversi? Sembrerebbe impossibile che una persona possa produrre più anticorpi dei geni esistenti nel genoma, che dovrebbero essere ordini di grandezza più grandi per accogliere il vasto numero di anticorpi.
A quanto pare, l’evoluzione ha prodotto meccanismi per risolvere questa discrepanza. Gli esseri umani possono generare una scorta apparentemente infinita di anticorpi unendo insieme segmenti genetici separati prima che vengano trascritti. Il processo è chiamato ipermutazione somatica, che consente alle cellule B di mutare i geni che usano per produrre anticorpi. Questo straordinario processo consente alle cellule B di produrre anticorpi che si legano fortemente a SARS-CoV-2 o a qualsiasi altro virus o specie batterica che invade il corpo.
Questi straordinari eventi biologici – la personalizzazione degli anticorpi e delle cellule B che formano i ricordi degli invasori – si verificano nei centri germinali dei linfonodi, un mondo a sé con demarcazioni “geografiche” di zone scure e chiare. Il centro germinale è dove le cellule B si attivano e proliferano. È anche il luogo in cui varie classi di immunoglobuline – anticorpi – che sono prodotti delle cellule B, si trasformano nelle varie classi di immunoglobuline: IgA, IgD, IgE, IgG e IgM. Nei centri germinali, le immunoglobuline aumentano anche la loro affinità per gli antigeni, frammenti di infiltrati che gli anticorpi riconoscono come pericolosi e cercano di distruggere.
A Londra sono in corso ricerche che stanno aprendo nuovi orizzonti nella comprensione dell’attività del centro germinale: come si attivano le cellule B e come le immunoglobuline raggiungono la loro straordinaria ampiezza e diversità. Le cellule B non entrano nelle zone chiare e scure dei linfonodi, volenti o nolenti. La loro entrata e uscita da queste regioni critiche dipende da una varietà di fattori, ciascuno volto a produrre tipi specifici di cellule B e inondazioni di anticorpi altamente specifici.
Una cellula B può essere una plasmacellula il cui ruolo è quello di secernere grandi quantità di anticorpi; oppure, una cellula B può essere una cellula B della memoria, che si forma all’interno dei centri germinali a seguito dell’infezione primaria. Le cellule B della memoria possono sopravvivere per decenni. Il loro ruolo è “ricordare” un agente infettivo, l’antigene.
Avere un ricordo di una precedente causa di malattia accelera la risposta la volta successiva che si incontra lo stesso antigene. Ci sono altre cellule B nei centri germinali, alcuni in fasi intermedie di sviluppo.
Il team londinese dell’Immunity and Cancer Laboratory del Francis Crick Institute sta studiando un processo noto come maturazione dell’affinità all’interno dei centri germinali dei linfonodi.
La maturazione dell’affinità è il processo in cui gli anticorpi sviluppano le loro acute affinità per gli antigeni. Un antigene può essere un frammento di un virus o un frammento di un batterio, ad esempio, che vengono portati ai centri germinali dalle cellule dendritiche. I dendritici non solo lanciano l’allarme sul pericolo, ma presentano le prove. I linfociti T si trovano anche nei centri germinali e sono i cardini della risposta immunitaria complessiva, anche giocando un ruolo nell’aiutare le cellule B a maturare. I centri germinali sono alveari di attività.
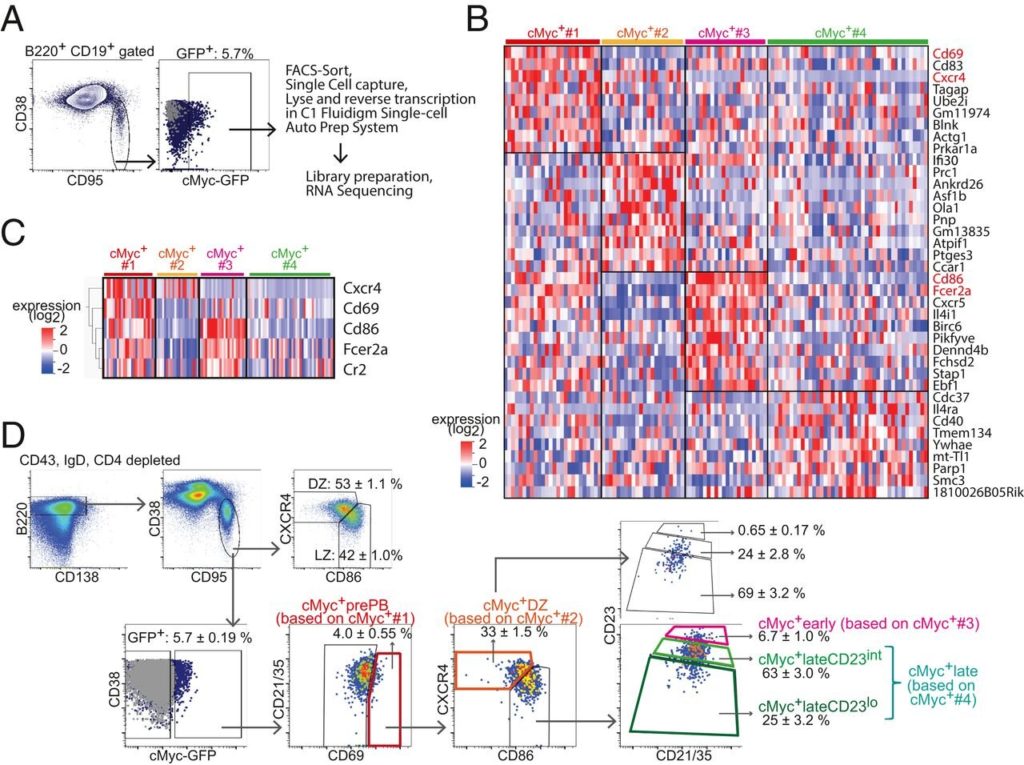
“La maturazione dell’affinità dipende dall’efficienza con cui i centri germinali selezionano positivamente le cellule B nella zona luminosa, dove le cellule dendritiche depositano frammenti di un infiltrato”, hanno scritto il dottor Rinako Nakagawa e un team del Crick Institute. La loro ampia analisi sulle attività nei centri germinali è pubblicata negli Atti della National Academy of Sciences .
“Le cellule B del centro germinale selezionate positivamente ricircolano tra la zona chiara e la zona scura e alla fine si differenziano in plasmablasti e cellule B della memoria”, riferiscono Nakagawa e il team del Crick Institute.
Il team di ricerca ha sottolineato che “le cellule B della zona chiara sono selezionate nei centri germinali in modo dipendente da cMyc, prima della migrazione della zona oscura”. Ciò significa che cMyc controlla le attività nei centri germinali.
L’oncogene cMyc funziona anche come regolatore del ciclo cellulare. È un fattore di trascrizione multifunzionale che guida una serie di attività necessarie per una rapida divisione cellulare. Inoltre inibisce l’espressione di geni con funzioni antiproliferative. A causa della sua capacità di indurre l’apoptosi, l’espressione di cMyc è strettamente regolata.
Come hanno scoperto Nakagawa e colleghi, cMyc è anche intimamente coinvolto nei meccanismi del centro germinale, svolgendo un ruolo nella formazione e nel mantenimento dei centri nei linfonodi in tutto il corpo. È una proteina di 62 kilodalton composta da 439 aminoacidi e appartiene alla classe dei fattori di trascrizione della chiusura lampo della classe elica-ansa-elica.
“Questo studio ridefinisce la selezione positiva delle cellule B del centro germinale come un processo dinamico che garantisce il mantenimento di un’ampia gamma di affinità nei centri germinali”, hanno scritto Nakagawa e colleghi. “Abbiamo scoperto che la divisione cellulare dipendente dall’affinità si è verificata nella zona chiara e quindi quel processo non è limitato alla zona scura”.
Mentre la ricerca del Crick Institute sta ridefinendo i meccanismi nelle zone chiare e scure, il loro lavoro si basa anche su studi che risalgono a decenni fa per chiarire come le cellule B e gli anticorpi maturano in forze chiave della difesa immunitaria.
La storia dietro la capacità umana di produrre trilioni di anticorpi è una delle più sorprendenti in natura e sottolinea perché il sistema immunitario dei mammiferi è una delle reti più complesse di sorveglianza e risposta nell’universo conosciuto.
In effetti, il sistema immunitario dell’uomo e di altri animali ha sviluppato meccanismi genetici che consentono loro di generare un numero incredibilmente alto di anticorpi. Unendo segmenti di geni separati insieme prima che vengano trascritti, è possibile produrre un’abbondanza di anticorpi. Non tutti i mammiferi utilizzano le stesse strategie, ma il risultato finale è un esercito molecolare di immunoglobuline che combattono le malattie che il corpo adatta per combattere gli infiltrati.

